治疗慢性阻塞性肺疾病的新方法——免疫调节剂
2023-12-08 09:40:44

《慢性阻塞性肺疾病诊治指南(2021年修订版)》中关于慢阻肺治疗的内容提及免疫调节剂治疗,推荐慢阻肺合并明确免疫缺陷患者在慢阻肺规范化治疗基础上针对具体的免疫缺陷参照相应指或专家共识进行治疗。免疫调节治疗主要针对慢阻肺患者免疫功能受损,治疗目标为改善患者免疫功能、减轻症状、减少感染和急性加重,但治疗目标并非在短期内可达成,在治疗过程中需密切观察其临床疗效和相关不良反应。

慢阻肺的免疫发病机制
慢阻肺是一种异质性疾病,其发病机制主要涉及炎性反应、蛋白酶-抗蛋白酶失衡、氧化应激、细胞凋亡与肺组织结构细胞代偿修复之间不平衡引起的气道重塑和肺泡破坏。有研究表明,自身免疫在慢阻肺的发生、发展中具有重要作用。近年来,与免疫学相关的机制在慢阻肺发生、发展中的作用受到广泛关注和重视。
局部固有免疫细胞在慢阻肺中的作用
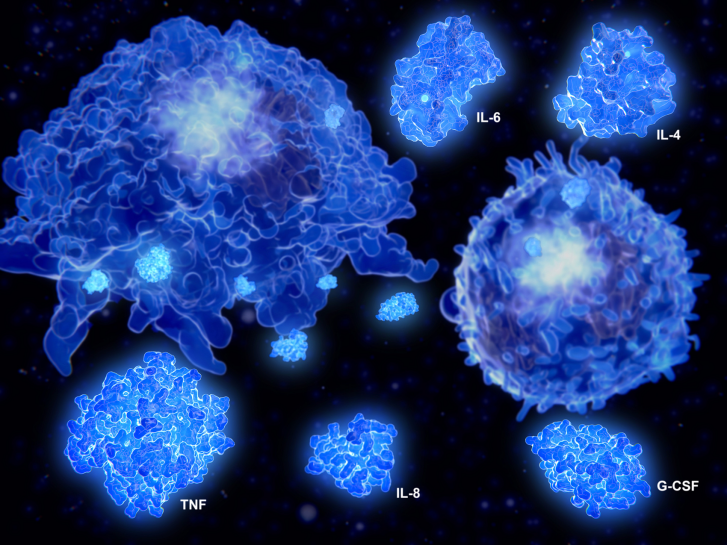
在香烟烟雾等外源性或内源性物质刺激下,肺组织局部上皮细胞、肺泡巨噬细胞、树突状细胞等固有免疫细胞被激活,其中气道上皮细胞和肺泡巨噬细胞可释放肿瘤坏死因子(tumor necrosis factor,TNF)- α、白介素(interleukin, IL)-1 β、IL-8、CC 亚族趋化因子配体(C-C chemokine ligand,CCL)-20 、CXC趋化因子配体(CXC chemokine ligand ,CXCL)-10等促炎细胞因子和趋化因子,导致相关炎性细胞及血管内皮细胞活化并增加其黏附分子/受体表达,继而促使中性粒细胞和单核细胞从血循环募集至肺组织。有研究发现,气道、肺实质、肺泡灌洗液和痰中巨噬细胞数量与慢阻肺严重程度呈正相关;

活化的中性粒细胞和巨噬细胞可通过释放氧自由基和蛋白质水解酶如中性粒细胞弹性蛋白酶和基质金属蛋白酶(matrix metalloproteinase ,MMP )-12 等而促进肺气肿的发展。此外,中性粒细胞弹性蛋白酶还参与黏蛋白的产生,而过多的黏液和受损的纤毛清除能力均与阻肺患者小气道阻塞有关。研究表明,部分慢阻肺患者存在嗜酸粒细胞增多现象,而嗜酸粒细胞释放的嗜酸性阳离子蛋白(eosinophil cationic protein,ECP)等碱性蛋白可损伤上皮细胞、加重气道炎症和肺泡破坏;慢阻肺加重程度和频次与巨噬细胞清除嗜酸粒细胞功能异常有关;
肥大细胞和自然杀伤细胞与小叶中央性肺气肿或肺泡破坏相关。还有研究发现,慢阻肺患者体内增多的3型固有淋巴样细胞(type 3 innate lymphoid cell,ILC3)可通过产生IL-17等细胞因子参与慢阻肺局部免疫应答;
气道黏膜上皮层及黏膜下层的 DCs 在受到香烟烟雾刺激后能迁移至纵隔淋巴结或局部气道黏膜淋巴滤泡,活化初始白细胞分化抗原(cluster of differentiation,CD)4+ 辅助性 T(helper T,Th)1 细胞和CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocyte ,CTL ),同时 DCs 还可以通过释放MMP-12 直接参与肺气肿的形成。
上述研究表明,固有免疫细胞在慢阻肺的发生、发展中至关重要。
局部适应性免疫细胞在慢阻肺中的作用
与固有免疫相比,适应性免疫的主要特征为对抗原识别的特异性、多样性和记忆性。既往研究发现,慢阻肺患者小气道周围和肺实质存在以B、T淋巴细胞 为主要成分的三级淋巴滤泡,尤以重度慢阻肺患者为明显,而微生物抗原、香烟烟雾成分或其衍生物、上皮损伤后暴露的组织蛋白、细胞外基质等均可能成为抗原或自身抗原并诱导适应性免疫应答、促进淋巴滤泡的形成。
研究表明,CD8+ CTL 活化后可释放穿孔素和颗粒酶,进而导致结构细胞凋亡或坏死,其数量与慢阻肺患者病情严重程度呈正相关。通常情况下,CD8+ CTL的活化需要CD4+ Th1细胞辅助,而CXCL-10和细胞因子IL-18对Th1细胞的募集和极化具有重要作用,后者可通过产生干扰素(interferon ,IFN)- γ 进一步激活巨噬细胞而加重炎性反应。另有研究发现,慢阻肺患者肺组织存在调节性T细胞,而该类细胞可通过细胞接触和分泌IL-10或转化生长因子β(transforming growth factor- β, TGF- β) 的方式负向调节T细胞和DCs功能。
慢阻肺患者炎性细胞分型
慢阻肺的临床表现存在明显异质性,在多种诱因刺激下,呼吸道炎性反应加重、黏液过度分泌及潴留增加等均可加重呼吸道症状,但不同诱因诱发的炎性反应不尽相同。《慢性阻塞性肺疾病诊治指南(2021年修订版)》指出,慢阻肺急性加重有可能是“细菌感染、病毒感染、 嗜酸粒细胞增高或寡细胞”的内因型,且其防治策略也应该有所不同。实际上,慢性气道疾病如哮喘和慢阻肺的炎性反应分型包括以固有淋巴细胞(innate lymphoid cell,ILC)1、Th1 细胞、巨噬细胞介导的1型炎性反应,以 ILC2、Th2 细胞、嗜酸粒细胞介导的2型炎性反应(T2 型炎性反应,以ILC3、Th17 细胞、中性粒细胞介导的3型炎症,而1型和3型炎性反应又归属于非T2型。

气道微生态改变与慢阻肺急性加重免疫学机制的关系
感染是慢阻肺的危险因素之一,而当病原体突破气道屏障时则会引发慢阻肺急性加重。 临床研究数据显示,吸烟人群和超过 50% 的慢阻肺稳定期患者存在气道微生物定植,而慢阻肺急性加重期患者微生物多样性与上述人群相比有所下降。sIgA 黏膜保护作用的下降和巨噬细胞吞噬功能失调是导致慢阻肺患者气道微生物定植的重要原因。
临床常见的引起慢阻肺急性加重的细菌包括流感嗜血杆菌、肺炎球菌、卡他莫拉菌、铜绿假单胞菌等。研究表明,细菌感染诱发的慢阻肺急性加重患者 IL-17 、TNF- α 等细胞因子表达水平升高,外周血Th1细胞和 CD8+ CTL 比例增加,Treg 比例降低,肺组织中中性粒细胞明显聚集。此外,细菌感染导致的慢阻肺急性加重期患者血清中多种抗体与稳定期患者相比也有明显变化,如血清免疫球蛋白(immunoglobulin,Ig)G、IgA、IgM 滴度下降且不能有效发挥抗体介导的调节作用,进而导致机体免疫防御水平降低。
病毒感染也是临床常见的导致慢阻肺急性加重的原因,常见的气道感染病毒包括人鼻病毒、流感病毒、 呼吸道合胞病毒、副流感病毒、冠状病毒等。研究表明, 病毒感染可引起外周血中性粒细胞、嗜酸粒细胞、 CD8+ CTL 增多, 细胞因子TNF- α、IL-6 高表达; CD8+ CTL 是机体抵御病毒感染的主要效应细胞,而流感病毒可引起 CD8+ CTL 抗病毒活性降低。另有研究发现,慢阻肺患者出现鼻病毒感染后血清 IL-21 、特异性抗体 IgG1 与稳定期相比明显降低,提示 病毒感染会导致慢阻肺急性加重期患者体液免疫损伤 。
鉴于气道微生物定植和感染在慢阻肺的发生、发展过程中发挥着重要作用,因此给予免疫调节剂如脾氨肽口服溶液或进行疫苗接种以改善慢阻肺患者机体免疫力、抗感染能力可能是防治慢阻肺的新途径。
双向免疫调节剂——脾氨肽口服溶液
脾氨肽口服溶液加强机体固有免疫系统的作用机制与路径:1、调节固有免疫及物理、化学、微生物屏障。2、通过激活杀伤细胞、单核细胞吞噬活性、增强中性粒细胞趋化功能,调节非特异性免疫功能。
脾氨肽口服溶液加强机体特异性免疫系统的作用机制与路径:1、脾氨肽口服溶液诱导DC细胞分化,诱导免疫耐受;2、当机体免疫水平较低时,脾氨肽口服溶液能够促进淋巴细胞增高,升高CD3+、CD4+细胞占比和CD4+/CD8+比值,升高IgG和IgM水平,增强机体对外界病原体抵抗的能力;3、可以阻断IgE与肥大细胞FcεRI受体结合。调节淋巴细胞功能,降低变应原血清特异性IgE水平;4、脾氨肽口服溶液能够降低Th2反应,影响Th1/Th2类细胞的表达,抑制IL-4、IL-5等2型细胞因子的分泌,升高IFN-γ、IL-2等I型细胞因子水平,促进Th1/Th2细胞向平衡水平转化;5、减少外周血中嗜酸、嗜碱性粒细胞,减轻炎症损伤;6、抑制组胺、白三烯等物质释放,减轻炎症症状。
总而言之,从机制上讲免疫调节剂是慢性阻塞性肺病治疗的新选择,其中脾氨肽口服溶液可以加强机体的固有免疫系统及特异性免疫系统功能,在慢性阻塞性肺病的治疗上值得更多研究者探索。
参考文献
[1]《慢性阻塞性肺疾病免疫调节治疗专家共识》撰写组.慢性阻塞性肺疾病免疫调节治疗专家共识[J].中国全科医学, 2022, 25(24):13.DOI:10.12114/j.issn.1007-9572.2022.0384.